法福来医疗首例跨省MAH项目成功落地
值此国内外法规更迭之际,国内医疗器械注册人制度作为当前热点之一,有助于优化资源配置鼓励创新,轻资产快上市。我司自政策发布时就持续关注,2020.02.13日配套发布的《长三角医疗器械制度跨省监管办法(试行)》,长三角试点工作走在全国前列,我司也紧随政策开始布局,首个项目即接手国际头部医疗企业三类医疗器械注册人制度实施的委托,依托我司对此类产品生产的丰富经验及注册人制度政策的长期摸索,在2023年协助客户顺利取得三类医疗器械产品注册证及我司受托生产许可证,预示我司首例注册人制度跨省委托生产项目成功落地。
注册人制度是现行医疗器械法规背景下的上市许可持有人制度,是指符合条件的医疗器械注册申请人可以单独申请医疗器械注册证,然后委托给有资质和生产能力的生产企业生产,从而实现产品注册和生产许可的“松绑”,让创新成果更易问世。如下图所示。

注册人制度以允许医疗器械成品外包生产为特征,明晰相关方法律责任与义务,其核心价值在于充分利用不同社会分工,让专业人做专业事。利用外包服务提供的专业化、规模化优势,为注册人节省人力物力,加快医疗器械上市。从委托关键零部件、原材料研发生产,到委托医疗器械设计开发、注册标准编制、产品验证、临床试验与临床评价,从委托质量管理体系建立与维护、产品注册代理,到委托生产、销售及售后服务,打通了全产业链外包服务活动。
此次三类医疗器械注册人制度跨省委托生产在我司成功落地也充分体现了我司在注册人制度大环境下的优势及价值。表一基于我司注册人制度实践案例中,对非注册人制度及注册人制度全生命周期对比,充分体现为客户缩短产品上市时间及周期,也为客户节约近一半的投入费用及隐形成本。
表1 非注册人制度及注册人制度下全生命周期对比
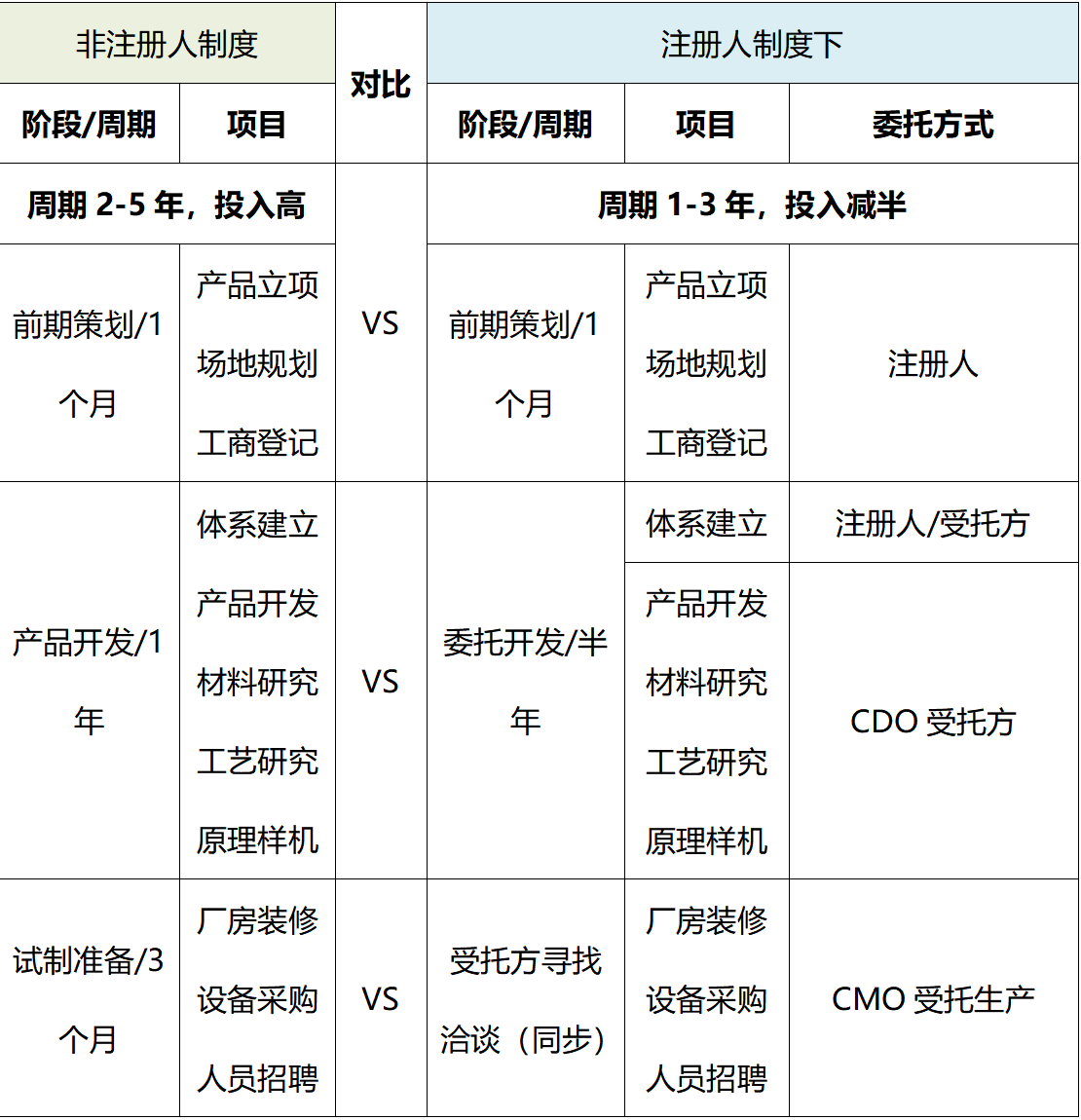
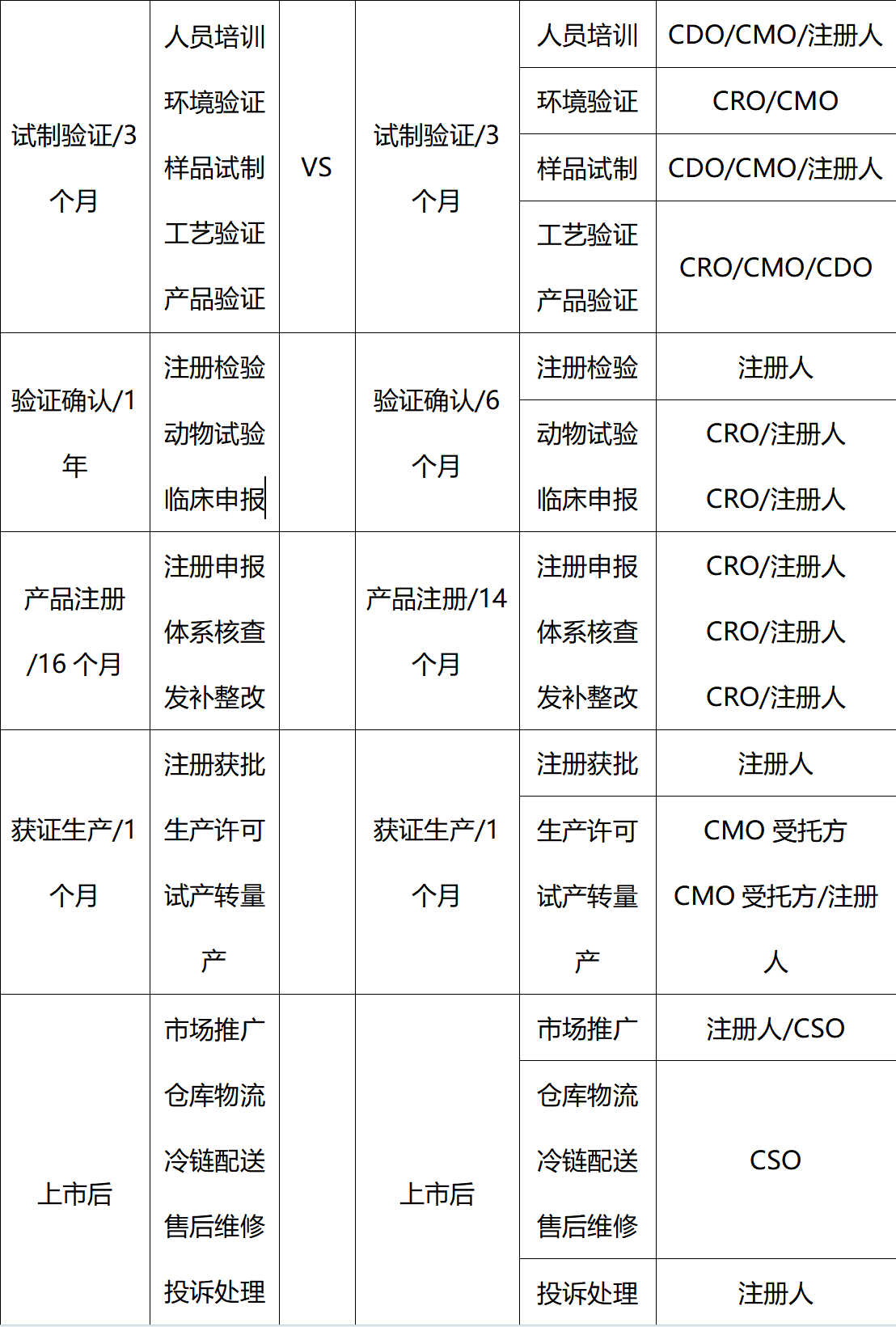
法福来医疗的核心价值观是以卓越的工程设计和反应能力来满足客户的需求。结合现行的医疗器械注册人制度及成功实践案例,我司综合优势如下:
一、数据及客户IP保护
法福来作为一家新加坡企业,因新加坡对个人数据立法保护,故我司非常注重客户IP保护,对于研发机构、高校及头部企业创新产品的数据及个人信息保护建立了健全的数据保护机制。让合作无后顾之忧。
二、专业化的开发能力
此次与医疗头部企业合作的产品为在常规麻醉器械的基础上进行了创新,是专门为中国市场开发的产品。我司作为一个不断致力于医疗设备制造的公司,公司专注于从事各种类医疗器械的制造、设计、研发、加工、组装、包装;从事医用塑料盖的设计、制造;提供售后服务及产品技术服务。可实现普通技术转移及定制研发与生产。此次合作,基于长期的研发能力及工艺设计积淀,快速为客户实现新产品委托开发,缩短开发周期,为创新产品的快速实现提供工艺路径。
三、具有竞争力的CDO/CMO企业
我司自成立伊始,致力于多种医疗器械生产能力的建设,我司拥有完善的万级,十万级净化车间及全套公用系统硬件设施,具备丰富的医疗成品生产经验,对产品的全套生产流程有丰富的经验,同时在工艺验证,包装验证,灭菌验证模块经验丰富。2023年我司年生产留置针3000万件,扩张器1000万件,辅助呼吸产品500万件。在气管插管及喉罩类产品具有规模化生产的制造能力,我司在此次注册人制度实施项目中,承担CDO及CMO角色,为客户减少厂房装修、设备投入及研发周期。如上文表一所述,减少近一半成本并缩短6个月-1年的上市时间。
四、国内外政策运用
基于对国内外企业如何通过注册人制度快速国产化、进口转国产104号文、海南乐城真实世界数据研究及创新医疗器械申报等政策时刻关注,为客户提供可靠、高效的注册路径。此次注册人制度的顺利实施,为客户赢得了时间。
随着注册人制度全面放开,以及企业跨省兼并重组、委托生产、异地注册等情形不断增多,产业高速发展,吸引了越来越多的高校、科研院所。注册人制度及其配套政策彻底改变了医疗器械商业化路径,注册人选择更加多样化,面临多重市场机遇。不少新创企业正在调整新研产品商业化路径,并优先考虑委托研发、委托生产的可行性;不少已取得上市许可的医疗器械生产企业正在重新评估自行生产与委托生产的效率与效益,思考企业如何落实注册人制度;部分细分领域的龙头企业正在按注册人制度要求,全面规划调整企业组织结构、管理模式、生产销售流程,以全面提高自身市场竞争力。
我司需顺应政策及市场的多重机遇,着力打造技术转移及定制研发与生产的服务能力,扩大定制研发范围及制造能力,紧追国内外医疗器械政策变化,为客户提供高质量产品、专业化路径及值得信赖的服务。希望通过此次跨省注册人制度的成功实施,为我们开启新的篇章。
撰稿人:赵晓青
媒体垂询
相关文章
2024-08-23
2024-05-21
2023-12-22
2023-12-22
2023-05-26
2023-05-26